Struttura del Cromosoma Y
Il Cromosoma Y è uno dei più piccoli cromosomi all'interno del
genoma umano. Viene ereditato come entità
aploide per via paterna e si presenta come un piccolo cromosoma
acrocentrico caratterizzato da una bassissima densità di geni e da una bassa
frequenza di mutazioni. È una molecola lineare con una dimensione complessiva
di circa 60 Mb. Di questi circa 24 Mb
riguardano la regione eucromatica e di
circa 30 Mb per quanto riguarda la regione eterocromatica,
insieme vengono indicati come la regione non combinante NRY ora denominato MSY (regione
specifica di sesso maschile), che corrisponde a circa il 95% del
cromosoma Y (Butler 2003). In origine conteneva 1500-2000 geni ora ne sono noti
una novantina (90 geni).
Il cromosoma Y è diventato il sistema di aplotipizzazione più utile
e informativo, grazie all'identificazione e la caratterizzazione di oltre 40 microsatelliti
( o short tandem repeats [ripetizioni brevi
in tandem]o STR, conosciuti anche come simple sequence repeats o SSR)
sequenze di DNA non codificante e oltre 220 polimorfismi a singolo nucleotide, SNPs (Jobling er al 2001).
In continua crescita per affidabilità I marcatori a Short Tandem
Repeats (STR) e I polimorfismi a Singolo Nucleotide (SNP) forniscono il campo
della scienza forense di uno strumento notevole per il profilo forense del DNA
per I casi che coinvolgono I test di paternità, le persone scomparse, le
aggressioni sessuali, tra cui le migrazioni umane e gli studi evolutivi e le
ricerche storiche e genealogiche (Buttler 2003).
Il cromosoma Y segue una successione puramente paterna per il 99,99%
ed è ereditato completo da padre in figlio attraverso generazioni ancestrali.
Rimane del tutto inalterato e non risente di influenze o scambi con il cromosoma X
della madre. (Buttler, 2003).
Ciò insieme al fatto che tutti I marcatori genetici lungo l'intera
lunghezza del cromosoma Y sono collegati tra loro, consente la costruzione di
Aplotipi da una combinazione di diversi marcatori che possono essere utilizzati
negli studi sulle migrazioni umane, la storia evolutiva e l'identificazione
umana (Butler, 2003).
- Cromosoma Y - Regione eterocromatiche e pseudoautosomica.
- Rappresentaizone estesa di una sezione del rendimento massimo sostenibile.
- Densità di geni che codificano unità trascrizionali e pseudogeni.
- % Nucleotidica all'interno di ALU, Geni Retrovirale, LINE1 e ripetizioni in tandem intervallate totali.
1.2 Regioni Pseudoautosomiche (PARs)
Da un punto di vista strutturale, il
cromosoma Y è costituito da due regioni localzzare alle estremità chiamate Regioni Pseudoautosomiche
(PAR1 e PAR2) e da una zona non
ricombinante (NRY) localizzata tra queste.
Le Regioni PARs sono le punte telomeriche del cromosoma,
quella che si trova nella parte distale del braccio
corto (Yp), viene denominata PAR1
ed è lunga circa 2,5 Mb mentre quella
regione PAR che si trova nella parte distale del braccio lungo (Yq), è
denominata PAR2, che è lunga meno di 1 Mb (Skaletsky et al., 2003).
Entrambi sono geni omologhi che si ricombinano con i geni omologhi del
cromosoma X durante la meiosi maschile consentendo quindi che si abbia luogo il
crossing over permettendo ai geni di segreggare come loci autosomici
(Butler,2003). Pertanto, i geni presenti in queste sequenze presentano
un'ereditarietà di tipo autosomico.
Inoltre, le PAR (in particolare la PAR1) sono molto
importanti, in quanto permettono una corretta segregazione cromosomica durante
la meiosi.
Il gene MIC2 (complesso maggiore di immunità), che codifica per una
glicoproteina di membrana CD99 si trova sul braccio corto in posizione Yp11.3 che subisce
crossing over con l'allele sul braccio corto del cromosoma X in posizione Xp22.23 (Skaletsky et
al., 2003).
1.3 Regione Eterocromatica
La Regione
Eterocromatica come accennato in precedenza è
di circa 30 Mb di lunghezza ed è situata sul braccio lungo distale (Yq) del
cromosoma Y (Skaletsky et al., 2003). Si compone di due grandi sequenze
altamente ripetute DYZ1 e DYZ2 (Gusmao et al, 1999).
Inoltre, il cromosoma Y è costituito da
due DYZ1 di
frammenti ripetuti, uno di 2,1 Kb di lunghezza e due tipi di Haemophilus aegyptius, frammenti HaeIII, Y-specifico, YS e la non-Y-specifico,
NSY (Gusmao et al. 1999). Il DYZ1 subisce mutazioni polari in entrambe le
regioni 5' e 3' del cromosoma Y e varie mutazioni hot spot (Ali et al. 2003).
1.4 Regione Specifica Maschile (MSY) o Regione non
Ricombinante (NRY)
Fra le regioni pseudoautosomiche (PARs),
come detto sopra, si trova una regione non omologa al cromosoma X che si
chiama, per tale motivo, Regione Non
Ricombinante (NRY non-ricombinig region of the human Y chromosome). Alcuni
ricercatori hanno attribuito a questa regione il nome di Male Specific Region
(MSY) per mettere in rilievo l'appartenenza di questa regione a individui di
sesso maschile. Ciò fu reso anche indispensabile in quanto le più recenti
scoperte su questa regione rendevano il veccchio nome di NRY non più valido e descrittivo in quanto gli studi
di genomica intrapresi da Skaletsky
et al. (2003) hanno fornito la prova di
una grande varietà di ricombinazione
intracromosomale in quella che era conosciuta
come la regione non ricombinante, la NRY, perciò venne rinominata Regione maschio-specifica maschile, la MSY (Skaletsky et al. 2003).
La regione specifica del sesso maschile,
MSY, comprende circa il 95% della lunghezza totale del cromosoma, ed è
costituita da una regione eucromatica ed una eterocromatica. Questa regione è
divisa in parti uguali da un mosaico di regioni eucromatiche, costituite da
geni funzionali e regioni eterocromatiche, aree prive di geni. (Skaletsky et
al., 2003). Una parte di questa regione eucromatica è stata sequenziata
(circa 23 Mb),
di questi 8 Mb sono situtati sul braccio corto Yp e 14,5 Mb localizzare sul
braccio lungo Yq. La restante parte del cromosoma, corrisponde a una regione di
eterocromatina di circa 30 Mb localizzata sul braccio lungo, è composta da Sequenze Altamente Ripetute non ancora sequenziate. Ad oggi non sono stati ancora
localizzati geni all'interno della regione eterocromatica.
La regione eucromatica è poi suddivisa in
tre ulteriori classi chiamate Regione X
trasposta, la Regione X-degenerata (X-Degenerative Region) e
la regione degli ampliconi (Ampliconic
Region) che contengono 156 unità di
trascrizione di cui 78 geni che codificano per proteine e 27 geni che
codificano per proteine distanti. (Skaletsky et al. 2003).
1.4.1 Regione del X-Trasposto
La Regione del X-Trasposto si trova in due blocchi di sequenza sul braccio corto Yp e
insieme sono lunghe circa 3,4 Mb e rappresentano circa il 15% del totale
dell'eucromatina nella Regione Maschio-Specifica (MSY) (Skaletsky et al. 2003).
Mostrano la densità genica più bassa e la più alta
densità di ripetizioni intervallate, di
cui il 36% è rappresentata da Lunghi Elementi Nucleari Interdispersi (LINE1),
in cui le tre classi dell'eucromatina MSY e sono caratteristici della sequenza
omologa sul cromosoma X a Xq21
Queste sequenze X-trasposte possono essere distinte
dalle sequenze pseudoautosomica alle estremità telomeriche di cromosomi X e Y,
in quanto non partecipano al crossing over XY durante la meiosi maschile (Skaletsky et al. 2003).
1.4.2 Regione X-Degenerata
La Regione X-degenerata si trova in otto blocchi di sequenza su entrambi I bracci,
quelo corto Yp e quello lungo Yq, tutti insieme sono lunghi circa 8,6 Mb e
rappresentano circa il 20% del totale dell'eucromatina MSY (Skaletsky et al. 2003).
Compresi in questa regine si trova 27 diversi geni a singola copia X-linked, di cui 13 pseudogeni non-funzionali
che contengono sequenze simili a quelle degli introni e degli esoni del X
omologo (Skaletsky et al.
2003).
Dei restanti 14, I due geni y-linked RPS4Y1 e RPS4Y2, omologhi del
gene RPS4X codifica X-linked per due isoforme non identiche della proteina ribosomiale S4 (famiglie di proteine funzionalmente correlate che
differiscono leggeremente nella sequenza aminoacidica), due geni Y-linked CYorfl15A e CYorfl15B, omologhi del
gene X-linked che codifica le regioni amino- terminale e carbossi-terminale
della proteina CXorfl15 e una si riferisce al gene funzionale SRY, la regione
che determina il sesso e 12 che codificano per proteine isoforme non identiche,
(famiglie di proteine funzionalmente correlate che differiscono leggermente
nella sequenza di aminoacidi) (Skaletsky et al. 2003).
1.4.3 Regione degli Ampliconi
La Regione degli Ampliconi si trova in
sette blocchi di sequenza di grandi dimensioni sia sul braccio corto Yp che sul
braccio lungo Yq che inseme sono lunghi circa 10.2 MB assomando a circe il 30%
della eucromatina MSY (Skaletsky et al. 2003).
Le sequenze Ampliconi presentano la più bassa densità
genica di LINE1ed elementi ripetuti intervallati e la più alta densità di geni
codificanti e non codificanti delle tre classi di eucromatina MSY (Skaletsky et
al. 2003).
La maggior parte dei geni di cui nove
proteine specifiche MSY che codificano faniglie geniche sono state identificate
(vedi immagine) VCY, XKRY, HSFY di cui esistono due copie BPY2 di cui esistono tre copie, CDY, DAZ di cui esistono 4 copie e RBMY di cui esistono sei copie. Vengono espressi esclusivamente
nei testicoli e codificano per proteine che sono specifiche per lo sviluppo, la
funzionalità e la fertilità dei testicoli nei maschi.
I Geni del cromosoma Y
AMELY: amelogenina sull'Y;
ASMTY:
acetilserotonin metiltransferasi sull'Y;
AZF1: fattore 1
dell'azoospermia;
AZF2: fattore 2
dell'azoospermia;
BPY2: proteina basica sull'Y;
CSF2RY: recettore
per il fattore stimolante le colonie di granulociti-mascrofagi, subunità alfa
sull'Y;
DAZ: gene deleto
nell'azoospermia;
IL3RAY: recettore
per l'interleuchina 3;
PRKY: protein
chinasi legata all'Y; (pseudogene)
SRY: regione
deteriminante il sesso sull'Y;
TDF: fattore di
determinazione testicolare;
TSPY: proteina
testicolo-specifica;
UTY: gene TPR
trascritto ubiquitariamente sull'Y;
ZFY: proteina a dita
di zinco sull'Y
I Marcatori del Cromosoma Y
Dal momento che a livello della NRY non avviene
ricombinazione, si avrà all'interno di questa regione un accumulo di eventi
mutazionali avvenuti nel corso delle generazioni lungo la linea esclusivamente
maschile.
Le due categorie di Marcatori Molecolari
usate per lo studio della variabilità del cromosoma Y sono I loci bi-alellici e i loci
multi-allelici.
- Fanno parte dei loci bi-allelici i Polimorfismi a Singolo Nucleotide (SNPs) e l'inserzione o delezione degli elementi Alu che portano entrambi alla comparsa di due possibili forme alleliche. Gli SNPs, cioè i polimorfismi a singolo nucleotide presentano uno specifico nucleotide che subisce un cambiamento nella copia di base attraverso meccanismo di sostituzione, di transizione o di trasduzione.
Questi
marcatori hanno un basso tasso di mutazione e sono considerati quasi eventi
unici (circa < 10-9 per generazione). Ad oggi, si è
riusciti a caratterizzare circa 250 marcatori bi-allelici del cromosoma Y
(Consorzio del Cromosoam Y, 2002).
- I loci multi-allelici comprendono due minisatelliti o VNTRs (Variable Number of Tandem Repeat) e più di 200 microsatelliti o STRs (Short Tandem Repeat). Si differenziano per lunghezza, quindi, ogni satellite è caratterizzato da una determinata sequenza nucleotidica di una certa lunghezza ripetuta diverse volte. Gli STR e i VNTRs sono delle sequenze intersperse per tutto il genoma umano e quindi presenti anche sul Cromosoma Y. Mostrano un elevato grado di variabilità interindividuale e per questo motivo sono stati spesso utilizzati negli studi di mappatura genetica, studi di linkage e per l'identificazione personale.
Un allele si differenzia
dall'altro per il numero di ripetizioni.
- Vengono definiti VNTRs I polimorfismi di lunghezza le cui unità base di ripetizione superano le 6 pb (> 6pb). In genere, consistono in ripetizioni di 15-20bp, con una lunghezza totale che varia da 300 bp ad 1 kb.
- Mentre gli STRs o Microsatelliti
hanno un segmento ripetuto lungo non più di 6 bp, in genere tra
2-5 nucleotidi, per una lunghezza totale di 100-200 bp.
Un esempio è l'STR DYS393 con un motivo di
ripetizione AGAT e l'STR DYS438 con un motivo ripetuto TTTTC. Un altro esempio è dato
nell'immagine a fianco:
La variabilità
degli alleli STRs e VNTRs è dovuta al numero
di ripetizioni con le quali l'unità di base si ripete all'interno della
sequenza in esame.
- Un altro marcatore multi-allelico usato nello studio dell'ereditarietà sono i Minisatelliti presenti in numero di due sul Cromosoma Y(Kaiser et al, 2004) che si compne di sequenze nucleotidiche della lunghezza che va da 10 a 60 paia di basi, un esempio è
CACAATATACATGATGTATATTATA
(tipo 1)
che entrambi si ripetono più volte in tandem (Gusmao et al. 2005).
Tassi di Mutazione
A causa degli elevati tassi di mutazione per i minisatelliti in media del 6-11% per
generazione mentre si stima che il tasso di mutazionedegli alleli STRs presenti sul cromosoma Y sia
mediamente dello 0,21% per generazione (de Knijff et al., 1997), vengono per
questo considerati dei polimorfismi ad evoluzione veloce.
Le mutazioni puntiformi (SNPs) vengono definite ad evoluzione lenta e si stima abbiano
un tasso di 3,0*10-8 di mutazioni
nucleotidiche per generazione (Xue et al.2009).
Marcatori Multi-Allelici (VNTRs e STRs)
I polimorfismi più
comunemente usati negli studi evolutivi sono I marcatori
bi-alellici e i microsatelliti che risultano essere
particolarmente funzionali nell'analisi di diversi periodi evolutivi in quanto
presentano differenti tassi di mutazione.
I marcatori bi-alellici per il loro basso
tasso di mutazione permettono di suddividere un gruppo di cromosomi in
aplogruppi, mentre, I marcatori multiallelici, come i microsatelliti, possono
essere usati per definire gli aplotipi dentro gli aplogruppi, indicando una maggiore diversità.
L'STR più ampiamente analizzato negli
studi di genetica di popolazione è il marcatore ipervariabile Y-specifico DYS19, caratterizzato per il momento
da 10 alleli di lunghezza che vanno da 174
bp a 210 bp e costituito da un motivo tetranucleotidico ripetuto (GATA)
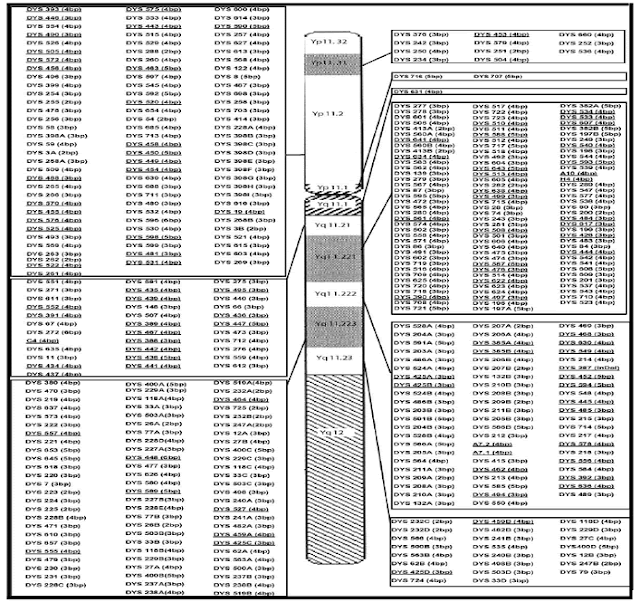
localizzato sul braccio corto Yp del Cromosoma Y (Quintana-Murch et al., 1999). La percentuale più alta di loci Y-STR si trova
all'interno del braccio
lungo del Cromosoma Y, di cui 25.3% in Yq11.221, 16,6% a Yq11.222 e 18,4% a Yq11.223 (Hanson et al.
2006). All'interno del braccio
corto del Cromosoma Y c'è il restante 22,1%
che si trovano in posizione Yp11.2, mentre all'interno del segmento centromerico vi sono tre
loci, DYS716
e DYS707 a Yp11.1 e DYS631 a Yq11.1 (Hanson et al., 2006). Le dimensioni di ciascun locus di ripetizione STR
vengono mostrati nella figura di sopra (Hanson et al. 2006).
Nomenclatura degli STR
Generalmente se il marcatore STRs è parte
di un gene, il nome del gene stesso è usato per la designazione del l'STRs (TH01, localizzato
all'interno del 1° introne (01) del gene codificante per la Tyrosine Hydroxylase: tirosina idrossilasi),
mentre se il marcatore si trova al di fuori del gene, esso viene designato in
base alla posizione cromosomica, es. D16S539, nel quale D significa DNA, 16 è il numero del cromosoma sul quale è localizzato l'STRs,
mentre S seguito da un numero indica la regione cromosomica 539: 539mo locus
descritto sul cromosoma16.
Un altro esempio di DNA intergenico è dato
da D5S818:
D = DNA
5 =
Cromosoma 5
S =
singola coppia nel genoma
818 =
818 818mo locus descritto sul cromosoma 5
I Marcatori Bi-allelici Y-SNPs
I marcatori bi-allelici sono i più
abbondanti polimorfismi che includono un gran numero di SNP e l'elemento di
inserzione ALU YAP-DYS287 (Underhill er al. 1996). Gli SNP sono polimorfismi a singolo nucleotide per cui un
nucleotide specifico subisce un cambiamento nella copia di base attraverso la
sostituzione, la transione o trasversione.
Il minisatellite MYS1 è altamente polimorfico ed ha un altissima variabilità
strutturale osservata utilizzando il metodo MVR-PCR con una eterozigosità
virtuale del 99,9% (Gusmao et al. 1999). Contiene una ricca sequenza ripetuta
dei due nucleotidi AT. Con gli alti tassi di mutazione e le difficoltà
incontrate nella tipizzazione dei campioni degradati, fornisce ancora un ottima
fonte nell'investigazione per gli studi di popolazione.
Il MYS2 (DYS440), è il minisatellite più lungo che contiene da 99 bp a 110
bp di sequenze ripetute, la sequenza di 99 bp ha un contenuto di GC del 45% con
una dimensione della matrice di 3 a 4 unità che si trova a meno di 1 Kb dal
gene DBY (Lahn and Page, 1997 Science) e mostra tassi di mutazione sufficientemente bassi e
livelli rilevabili di variazione in molti lignaggi (Bao et al., 2000). Le unità
contengono ciascuna una breve sequenza palindroma CCTAGG e duplicata in più per
CCTAGGCCTAGG (BAO et al., 2000).
Gli SNP si sono dimostrati essere potenzialmente utili
nella costruzione di Aplogruppi per le indagini nella popolazione e negli studi
evolutivi; comunque, è indispensabile che gli SNP più appropriati siano
meticolosamente selezionati ai fini di genetica forense dagli altri differentu
SNPs che possono eventualmente definire lo stesso aplogruppo (Sanchez et al.,
2004).
Due SNP altamente polimorfici comunemente
usati e di potenziale interesse sono i loci Y-specifici P25 e 92R7 ampiamente usati
negli studi della popolazione
europea, si cui entrambi rappresentano
importanti punti di ramificazione sull'albero degli aplogruppi e che sono stati
studiati recentemente da Sanchez et al. (2004).
Gli studi di Sanchez JJ. hanno dimostatrato che in realtà non sono un
unico come inizialemte pensato, che sono delle varianti di sequenza paralogous,
PSVs che hanno avuto origine da duplicazioni segmentali con almeno una delle
varianti polimorfiche essendo all'interno di ciascun gruppo di loci (Sanchez et
al., 2004).
I Polimorfismi Alu
I Polimorfismi
Alu sono un esempio di sequenze intersperse di DNA , sparse un pò per tutto il genoma in maniera casuale. Le
sequenze intersperse si distinguono in SINEs (Short Interspersed Elements, lunghe 100-300 bp) e le LINEs (Long Interspersed
Elements, lunghe 6-8 Kbp), entrambi trasposoni non virali.
Le Sequenze Alu dal punto di vista
genetico corrisponde alla sequenza di nucleotidi che codifica per la particella SRP, un ribonucleotide coinvolto
nel trasporto cellulare delle proteine. Questo gene nel corso dell'evoluzione è
stato duplicato tantissime volte all'interno del nosto genoma (anche nel
Cromosoma Y). Le sequenze Alu si riscontrano quasi esclusivamente nei primati
anche se il ribosoma 7s sia praticamente presente in ogni forma di esseri
viventi. 7.000 inserzioni Alu sono tipiche degli uomini.
La maggior parte di queste copie non sono funzionali,
molte sono tronche o piene di mutazioni.
Il processo di duplicazione spesso è
impreciso ed essendo sequenze simili spesso favoriscono fenomeni di crossing
over. I principali fenomeni di variazioni nella lunghezza degli alleli sono
creati da mutazioni per via di inserzioni o delezioni in genere di un nucleotide (1 bp) del Dna. Un tipico inserimento
che si è dimostrato essere particolarmente utile in particolari studi di gruppi
di aplotipi all'interno delle popolazioni è il polimorfismo
Y Alu (YAP), che è stato anche il primo marcatore bi-allelico
del Cromosoma Y ad esser stato scoperto (Hammer et al. 1994).
Le sequenze Alu prendono questo nome dal
fatto che nel processo di taglio da parte degli enzimi
di restrizione queste sequenze vengono
riconosciute come sito di taglio dall' endonucleasi
Alu., il nome dell'enzima deriva dall'Arthrobacter luteus, l'organismo da cui è stato isolato originariamente.
Le sequenze Alu consistono generalmente di
circa 300 bp,
di cui mezzo milione di coppie sono state inserite in regioni specifiche sul
cromosoma Y (Hammer et al.
1994). Uno dei polimorfismi Y Alu più
comunemente usati e stabili è il DYS287 la cui presenza è indicata dalla
presenza o assenza di un elemento Alu di 303 bp sul braccio lungo del Cromosoma
Y (Quintana-Murch et al.
1999).
La seguente sequenza di DNA che codifica per i 299 nucleotidi dell'RNA
7SL :
GccgggcgcggtggcgcgtgcctgtagtcccagctactcgggaggggagagaggcgcgctgctcgctcgcctutctctgataaattuctgAGGCTGgaGGATCGcttgAGTCCAggAGTTCTgggctgtagtgcgctatgccgatcgggtgtccgcactaagttcggcatcaatatggtgacctcccgggagcgggggaccaccaggttgcctaaggaggggtgaaccggcccaggtcggaaacggagcaggtcaaaactcccgtgctgatcagtagtgggatcgcgcctgtgaatagccactgcactccagcctgggcaacatagcgagaccccgtctct
La sequenza evidenziata è il sito di taglio
riconosciuto dall'enzima di restrizione.
Amelogenina
Il gene AMELY (amelogenina) presente sul Cromosoma Y e il suo omologo sul Cromosoma
X, il gene AMELX, sono entrambi unici,
coinvolti nella fase dell'ontogenesi
(l'amelogenesi) durante la quale gli ameloblasti formano lo smalto dei denti e nella
dentinogenesi processo della formazione della dentina durante lo sviluppo umano
(Butler, 2005).
La determinazione del sesso non è solo uno strumento
utile, ma di estrema necessità nelle indagini forensi in particolare nei casi
di violenza sessuale, macchie di sangue datate e resti scheletrici umani per I
quali metodi precisi e affidabili di indagine sono della massima importanza (Butler, 2005).
Gli Aplogruppi del Cromosoma Y
La scelta dello studio dei marcatori SNPs e STRs del
Cromosoma Y per la mappatura genetica, nelle analisi forensi e per lo studio
della dispersione delle popolazione durante la storia dell'uomo è caduta sul
cromosoma Y per la caratteristica peculiare di questo cromosoma che essendo a
trasmissione uniparentale e presente in singola copia all'interno del cariotipo
maschile presenta mancanza di ricombinazione
e una frequenza estremamente bassa di retromutazione.
Questi fattori messi insieme hanno permesso di costruire un albero filogenetico estremamente preciso e con
una bassa ambiguità di interpretazione rispetto a quello ottenuto tramite
l’mtDNA.
La regione
non ricombinante del cromosoma Y (NRY) ha oggi
la maggior risoluzione aplotipica per ogni locus di qualsiasi altro
sistema
del genoma, e
sono stati riconosciuti
e raccolti in una dettagliata
filogenesi 153 aplogruppi, definiti
da marcatori
biallelici.
Queste caratteristiche permettono di
osservare dopo l'analisi di questi STRs la generazione, per ogni marcatore, di
un genotipo costituito da un singolo allele ad eccezione dei marcatori DYS385a/b e DYS389I e DYS389II.
Nel primo caso il marcatore è presente in due regioni
distinte del cromosoma Y, la cui amplificazione da una singola coppia di
primers produce due differenti amplificati (quindi due alleli differenti).
L'allele di dimensione minore è chiamato a, quello di dimensione maggiore
"b".
Mentre nel caso dei marcatori DYS389I e DYS389II i due alleli
non identificano due regioni completamente distinte, ma sono uno parte
dell'altro: In particolare il primer forward è complementare a due distinte
regioni localizzate vicine, mentre il primer reverse riconosce solo una
regione. Da ciò si ha che sempre a partire da una singola coppia di primers
verrano generati due alleli.
Un aplotipo (dal
greco haplòos che significa "singolo",
"semplice")
è la
combinazione di varianti alleliche di
un set di marcatori polimorfici che si
trovano fisicamente su un cromosoma o un segmento
cromosomico con loci in linkage
disequilibrium, cioè strettamente associati tra loro. Questi alleli si presentano associati in
aplotipi grazie alla mancanza di ricombinazione fenomeno che permette loro di
venir ereditati in modalità uniparentale, paterna in questo caso, materna nel
caso degli aplotipi del mtDNA.
L'aplogruppo rappresenta un insieme di aplotipi (combinazioni di
marcatori) di cui si ipotizza un origine come, grazie alla condivisione di
mutazioni caratteristiche (generalmente ad evoluzione lenta). Per il
cromosoma Y, l’aplotipo
è costituito dalla
somma della variabilità di
polimorfismi microsatelliti (STRs).
L’aplogruppo
si definisce sulla
base della condivisione
di mutazioni specifiche per marcatori biallelici (SNPs) e
non per i microsatelliti, poiché hanno un tasso di mutazione troppo alto (fig.
5).
Negli ultimi decenni è andato sempre più
crescendo il numero dei marcatori biallelici scoperti che ha
portato al nascere
di almeno sette diverse
nomenclature. Questo
ha recato notevoli
disagi
nel confronto dei
risultati delle varie
pubblicazioni, tanto che,
nel 2002, l’Y
Chromosome Consortium (YCC) ha
pubblicato un albero
filogenetico del cromosoma
Y costruito tramite
l’analisi di marcatori
(SNPs), genotipizzati in un set di
campioni
rappresentativo di tutte le popolazioni.
Ed ha stabilito un sistema per denominare I 18
aplogruppi (clades) principali del Y-DNA basato sulle lettere da A a T, con
ulteriori divisioni usando numeri e lettere in pedice.
È stato messo a punto un semplice insieme di regole per
etichettare in maniera non ambigua I diversi clades localizzati all'interno di
questo albero.
Viene considerato cromosoma Y ancestrale
("di Adamo") quello appartenuto a un maschio teorico che
rappresenta il più recente progenitore comune (MRCA Most Recent Common Ancestor) di tutti i maschi attuali
lungo la linea patrilineare, visto che il cromosoma Y è unicamente trasmesso
dal padre ai figli maschi. La stima di quando questo individuo teorico sia
vissuto varia a seconda degli studi. Anche se in linea generale si ipotizza che
sia vissuto in Africa circa 70.000 anni fa. Partendo da questo punto si può datare la
comparsa di tutte le successive mutazioni e di conseguenza degli aplogruppi che
oggi caratterizzano la popolazione umana.
L'aplogruppo più antico è l'Aplogruppo A ed è
localizzato prevalentemente nell'Africa Sub-Sahariana, che si pensa possa
essere stata la culla dell'uomo anatomicamente moderno. Da questo aplogruppo
poi sono derivati tutti gli altri diffondendosi per il mondo attraverso le
migrazioni avvenute durante il corso della storia umana.
Si pensa che la linea evolutiva
caratterizzata dalla mutazione
M89 si sia
originata in Africa Orientale, a partire dalla linea originale M168 dell'Adamo
Eurasiatico, circa 45.000 anni fa. Essa si sarebbe diffuda dall'Africa (passando per
lo Stretto di Bab El Mandeb) verso l'Asia
Occidentale , e da qui si sarebbe espansa
dapprima in Medio Oriente e poi verso nord ed est circa 40.000 anni fa, fino a
colonizzare gran parte del continente (Underhill et al. 2001).
A partire da M89 si sono in seguito
differenziate ulteriori linee caratterizzate ognuna da particolari
polimorfismi. Due di tali linee, M170 e M173, sembrano essere state presenti in Europa sin dal
Paleolitico (Semino et al., 2000).
Di queste, M170 sembra essere una
linea tipicamente europea, in quanto assente al di fuori del continente (Bosch
et al., 2001). Lungo questa linea si trova la mutazione M26 che è caratteristica
della Sardegna dove si trova con una frequenza di circa il 37% (Ghiani et al., 2009; Contu et al., 2008;
Francalacci et al., 2003; Semino et al.; 2000; Passarino et al., 2001).
- Applicazioni Forensi.
3.1 Violenza Sessuale.
I polimorfismi Y-specifici, in modo particolare STRs
hanno dimostrato di essere uno strumento discriminante particolarmente utile
nelle indagini forensi nella rilevazione della frazione maschile del DNA e con
la generazione di profili genetici ottenuti da macchie di fluidi corporei misti
recuperati da casi di violenza sessuale in cui sono coinvolti soggetti maschili
sospetti compresi quelli che sono azoospermici, come nelle aggressioni
maschio/femmina e nelle aggressioni sessuali tra maschio/maschioe e nella
determinazione del numero di donatori maschili associati a stupri di gruppo (Hanson et al. 2006).
3.2 Test di Paternità
Il modello di ereditarietà lungo la linea
maschile rende I polimorfismi Y-STR adatti per il test di
paternità in caso di discendenza maschile, o
nei casi di carenza in particolare quando il padre si ipotizzi morto, è
possibile ottenere l'accesso alla sua completa informazione sull'Y-cromosoma
usando il DNA proveniente da qualsiasi parente maschio nella discendenza
patrilineare.
Un aspetto importante da tenere in considerazione
durante il test di paternità e nell'analisi forense è l'accurata
interpretazione dei profili genetici tenendo in considerazione la percentuale I
tassi di probabilità percentuali di potenziali mutazioni STR che potrebbe
escludere o includere la paternità biologica di un padre putativo (Kayser et al. 2001).
Come risultato
di questa e precedenti raccomandazioni di indagini sono state fatte per la Società Internazionale di Genetica
Forense, il ISFG per ridefinire I criteri dei test di paternalità per capire
che l'esclusione della paternità dovrebbe essere basata sulla possibilità di
mutazioni che si verificano in tre loci quando un minimo di nove loci STR
vengono analizzati (Kayser et al., 2001).
3.3 Inferenza di Origine Geografica Storica e Ricerca
Genealogica
Le indagini sulla popolazione basate basate sugli
aplotipi tra cui I loci bia-allelici, I loci STR e il minisatellite MSY1
sembrano essere la migliore strategia sembrano essere la migliore strategia per
l'utilizzo negli studi di genetica ed evolutivi di una popolazione. Alberi
genetici basati su strategie a rete mediana includendo tutti i marcatori che
permettono una migliore analisi delle popolazioni nonchè una maggiore
informazione negli studi evolutivi. (Gusmao et
al., 1999).
Nuove opportunità sono sorte grazie all'individuazione
di molte centinaia di validi e affidabili Y-polimorfismi binari compatibili con
la PCR che forniscono nuove aree per l'analisi del DNA specifico di sesso
maschile all'interno di una vasta diversità di popolazoni e sub-popolazioni che
possono fornire la prova di discendenza biogeografica (Underhill et al., 2001; Ali et
al., 2003).
L'Y-SNP per l'assenza di ricombinazione, per i tassi
estremamente bassi di mutazione e l'ereditarietà paterna rappresenta uno
strumento prezioso che è relativamente adatto per l'identificazione di linee
paterne stabili e l'esplorazione dell'evoluzione umana (Onofri et al. 2005).
Una serie di sei gerarchie multiples (figura seguente) è stata sviluppata da
Onofri et al, che sono localizzate nei rami basali e più profonda dell'albero
filogenetico per esplorare i principali cladi
AR e i sublcadi consentendo di discriminare gli aplogruppi che
appartengono a continenti specifici (Onofri V et al., 2005).
Figura 3.3.1 elettroferogrammi e cladogrammi dei sei multiplex gerarchiche Y-SNP
(Onofri et al 2005
Bibliografia:
- The human Y chromosome - https://universe-review.ca/R11-14-Ychromosome.htm>
- Tesi di dottora to di Laura Corrias PhD- L’isolamento degli isolati sardi - Carloforte e Benetutti
- Eupedia: Distribution of European Y-chromosome DNA (Y-DNA) haplogroups by region in percentage. See note n° 4.
- Evaluation of the Y-chromosome Structure - Glenda Melling https://www.uclan.ac.uk/students/research/crit/melling.php>
- Adams, S et al. 2005. ‘The case of the unreliable SNP: Recurrent back-mutation of Y-chromosomal marker P25 through gene conversion’, Forensic Science International 159, 14-20.
- Ali, S and Hasnain, S.E. 2003. ‘Genomics of the human Y-chromosome 1. Association with male infertility’, Gene 321, 25-37.
- Bao, W et al. 2000. ‘MSY2: a slowly evolving minisatellite on the human chromosome which provides a useful polymorphic marker in Chinese populations', Gene 244, 29-33.
- Behlke, M.A et al. 2003. ‘Evidence that the SRY protein is encoded by a single exon on the human Y-chromosome’, Genomics 17, 736-739.
- Butler, J.M. 2003. ‘Recent developments in Y-short tandem repeat and Y-single nucleotide polymorphism analysis’, Forensic Science Review 15-2.
- Butler, J.M et al. 2005. ‘Chromosomal Duplications Along the Y-Chromosome and Their Potential Impact on Y-STR Interpretation’, Journal of Forensic Science 50.
- Dupuy, B.M et al. 2004. ‘Y-chromosomal microsatellite mutation rates: differences in mutation rates between and within loci’, Human Mutation 23, 117-124.
- Gusmão, L et al. 1999. ‘Y-chromosome specific polymorphisms in forensic analysis’, Legal Medicine 1, 55-60.
- Gusmão, L et al. 2005. ‘Mutation rates at Y-chromosome microsatellites’, Human Mutation 26, 520-528.
- Gusmão, L et al. 2006. ‘DNA Commission of the International Society of Forensic Genetics (ISFG): An update of the recommendations on the use of Y-STRs in forensic analysis’, Forensic Science International 157, 187-197.
- Hammer, M.F. 1994. ‘A recent insertion of an Alu element on the Y-chromosome is a useful marker for human population studies’, Molecular Biology Evolution 11, 749-761.
- Hammer, M.F et al. 1997. ‘The geographic distribution of human Y-chromosome variation’, Genetics 145, 787-805.
- Hanson, E.K and Ballantyne, J. 2006. ‘Comprehensive annotated STR physical map of the human Y-chromosome: Forensic implications’, Legal Medicine 8, 110-120.
- Hurles, M.E and Jobling, M.A. 2001. ‘Haploid chromosomes in molecular ecology: lessons from the human Y’, Molecular Ecology 10, 1599-1613.
- Jobling, M.A, Bouzekri, N and Taylor, P.G. 1998, 1998a. ‘Hypervariable digital DNA codes for human paternal lineages: MVR-PCR at the Y-specific minisatellite, MSY1 (DYF155S1)’, Human Molecular Genetics 7, 643-653.
- Jobling, M.A and Tyler-Smith, C. 2001. ‘Y-chromosomal SNP haplotype diversity in forensic analysis’, Forensic Science International 118, 158-162.
- Kayser, M and Sajantila, A. 2003. ‘Mutations at Y-STR loci: implications for paternity testing and forensic analysis’, Forensic Science International 118, 116-121.
- Kayser, M et al. 2003. ‘Y chromosome STR haplotypes and the generic structure of U.S. populations of African, European and Hispanic ancestry’, Genome Research 13, 624-634.
- Lahn, B.T. and Page, D.C, 1997. ‘Functional coherence of the human Y-chromosome’, Science 278, 675-680.
- Onofri, V et al. 2006. ‘Development of multiplex PCRs for evolutionary and forensic applications of 37 human Y chromosome SNPs’, Forensic Science International 157, 23-25.
- Quintana-Murci, L et al. 1999. ‘Y-chromosome specific YCAII, DYS19 and YAP polymorphisms in human populations: a comparative study’, Annual Human Genetics 63, 153-166.
- Roewer, L. 2003. ‘The use of the Y chromosome in forensic genetics – current practices and future perspectives’, International Congress Series 1239, 279-280.
- Rozen, S et al. 2003. ‘Abundant gene conversion between arms of palindromes in human and ape Y-chromosomes’, Nature 423, 873-876.
- Sanchez, J.J et al. 2004. ‘Duplications of the Y-chromosome specific loci P25 and 92R7 and forensic implications’, Forensic Science International 140, 241-250.
- Shewale, J.G et al. 2004. ‘Y-Chromosome STR System, Y-PLEX™ 12, for Forensic Casework: Development and Validation’, Journal of Forensic Science 49.
- Sinclair, A.H et al. 1990. ‘A gene from the human sex-determining region encodes a protein with homology to a conserved DNA-binding motif’, Nature 346, 240-244.
- Skaletsky, H et al. 2003. ‘The male specific region of the Y chromosome is a mosaic of discrete sequence classes’, Nature 423, 825-837.
- Underhill, P.A et al. 1996. ‘Detection of numerous Y-chromosome biallelic polymorphisms by denaturing high-performance liquid chromatography’, Genome Research 7 996-1005.
- Underhill, P.A et al. 2001. ‘The phylogeography of Y-chromosome binary haplotypes and the origin of modern human populations’, Annual Human Genetics 65, 43-62.
- Y Chromosome Consortium. 2002. ‘A nomenclature system for the tree of human Y-chromosomal binary haplogroups’, Genome Research 12, 339-348.














Nessun commento:
Posta un commento